新闻中心
2025年5月28日,国家药品监督管理局药品审评中心(CDE)正式受理麓鹏制药自主研发的第四代BTK抑制剂洛布替尼片(Rocbrutinib)的新药上市申请(NDA),并已将其纳入优先审评程序,拟用于治疗既往接受过布鲁顿氏酪氨酸激酶(BTK)抑制剂治疗的成人套细胞淋巴瘤(MCL)患者。若获批,预计是中国首个获批该适应症的国产BTK抑制剂。
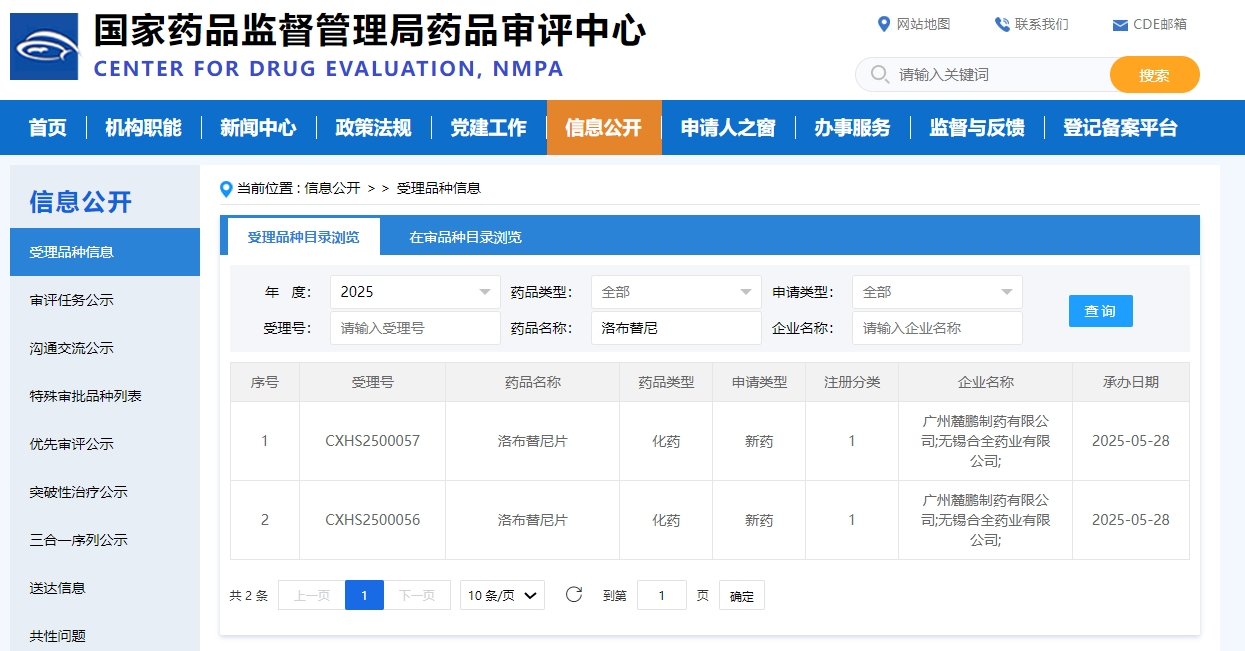
本次NDA申请是基于一项在中国开展的二期关键性注册临床研究(CTR20230100)结果。研究旨在评估洛布替尼单药用于复发或难治(R/R)MCL患者的疗效及安全性,由北京大学肿瘤医院朱军教授、宋玉琴教授牵头,全国40余家研究中心参与。此项研究的结果将于今年9月在中国临床肿瘤学会(CSCO)学术年会上正式公布。
此前,在2023年美国血液学会年会上公开了洛布替尼I期临床研究(CTR20211173)中R/R MCL队列的阶段性数据(截止2023年5月31日)。在17例既往接受过BTK抑制剂治疗的患者中,有12例获得缓解,客观缓解率(ORR)高达70.6%,且包含6例(35.3%)达到完全缓解(CMR/CR),显示了洛布替尼在既往BTK抑制剂治疗耐药的MCL患者人群中的治疗潜力。2023年9月,基于突出的疗效和良好的安全性,CDE同意洛布替尼单药针对R/R MCL适应症启动关键性注册临床研究。此外,洛布替尼单药或联合用药方案用于治疗多种B细胞淋巴瘤的临床研究正在中美同步开展中。
麓鹏制药董事长、CEO兼CMO谭芬来博士表示,洛布替尼新药上市申请的受理是公司的重要里程碑事件,在此特别感谢参与该研究的研究者与患者、投资人和相关部门的信任、支持和帮助,感谢公司全体员工坚持不懈的努力!我们将一如既往地坚持创新驱动,以临床需求为导向开发更多更好的创新药,造福广大患者。
关于MCL
MCL是成熟B细胞非霍奇金淋巴瘤(NHL)的一种亚型,约占成人NHL的2.5%-6%。该病在治疗中表现为反复复发,目前尚不可治愈,且随着治疗线数的增多,患者的缓解率、缓解深度和缓解持续时间均较前线明显缩短,甚至逐渐出现耐药,例如对BTK抑制剂耐药的患者,后续治疗选择有限,预后极差。因此,该领域具有很高的未被满足的医疗需求,迫切需要新型药物的开发。
关于洛布替尼
洛布替尼(LP-168)是全球首个第四代共价兼非共价BTK抑制剂,不仅能克服多种由BTK突变导致的对第一、二、三代BTK抑制剂的耐药,而且具有极高的活性和优异的靶点选择性,有望成为一款Best-in-Class BTK抑制剂。该药正在开展的临床研究适应症主要为各类B细胞淋巴瘤,特别在复发/难治性的非生发中心B细胞样型弥漫大B细胞淋巴瘤(R/R non-GCB DLBCL),洛布替尼显示了特别优异的疗效,并于2024年5月在中国被CDE纳入突破性治疗品种名单,为中国首个被认定为DLBCL突破性疗法的BTK 抑制剂, 也是全球唯一一个在DLBCL获BTD认可的BTK抑制剂。此外,该药针对R/R non-GCB DLBCL适应症的关键性注册II期临床研究近期也获得CDE批准。

